ARTICULO 1.THE FLUID MOSAIC MODEL OF THE STRUCTURE OF CELL MEMBRANES
AUTOR: S.J. SINGER AND GARTH L.NICOLSON
El modelo de mosaico fluido es, en biología, un modelo de la estructura de la membrana plasmática propuesto en 1972 por S. J. Singer y Garth Nicolson gracias a los avances en microscopía electrónica, el estudio de interacciones hidrófilas, al estudio de enlaces no covalentes como puentes de hidrógeno y el desarrollo de técnicas como la criofractura y el contraste negativo.
Un modelo de mosaico fluido se presenta para la organización bruto y la estructura de las proteínas y los lípidos de las membranas biológicas. El modelo es consistente con las restricciones impuestas por la termodinámica. En este modelo, las proteínas que son parte integral de la membrana son un conjunto heterogéneo de moléculas globulares, cada una dispuestas en una estructura anfipática, es decir, con los grupos iónicos y polares altamente sobresalen de la membrana en la fase acuosa, y los grupos no polares en gran parte sepultado en el interior hidrofóbico de la membrana. Estas moléculas globulares están parcialmente incrustadas en una matriz de fosfolípidos. La mayor parte de los fosfolípidos está organizada como una doble capa discontinua, fluida, aunque una pequeña fracción de los lípidos pueden interactuar específicamente con las proteínas de membrana. La estructura de mosaico fluido es por lo tanto, formalmente análogo a una solución orientada en dos dimensiones de las proteínas integrales (o lipoproteínas) en la bicapa de fosfolípidos solvente viscoso. Experimentos recientes con una gran variedad de techniqes y varios sistemas de membrana diferentes se describen, todo lo cual instigar consistente con, y añadir mayor cantidad de detalles que, el modelo de mosaico fluido. Por lo tanto, parece apropiado sugerir posibles mecanismos para funciones de la membrana y fenómenos mediados por membrana a la luz del modelo. A modo de ejemplo, los mecanismos comprobables experimentalmente, se sugieren los cambios de la superficie celular en la transformación maligna, y para efectos de cooperación expuesto en las interacciones de las membranas con algunos ligandos específicos.
Nota añadido en la prueba: Dado que este artículo fue escrito, se han obtenido pruebas de microscopía electrónica (69) que la concanavalina A los sitios de unión en las membranas de fibroblastos de ratón transformado SV40-virus (células 3T3) están más agrupadas que los sitios en las membranas de las células normales, como predice la hipótesis representada en la figura. 7B. T-aquí también ha aparecido un estudio de Taylor et al. (70) que muestra los efectos notables producidos en los linfocitos de la adición de anticuerpos dirigidos a las moléculas de inmunoglobulina de superficie. Los anticuerpos induce una redistribución y pinocitosis de estas inmunoglobulinas de superficie, de manera que en unos 30 minutos a 37 ° C las inmunoglobulinas de superficie están completamente barridos de la membrana. Estos efectos no se producen, sin embargo, si los anticuerpos bivalentes se sustituyen por los fragmentos Fab monovalente o si los experimentos de anticuerpos se llevan a cabo a 0 ° C en lugar de 37 º C. Resultados de estos y otros indican claramente que los anticuerpos bivalentes produce una agregación de las moléculas de inmunoglobulina de superficie en el plano de la membrana, que puede ocurrir sólo si las moléculas de inmunoglobulina son libres de difundir en la membrana. Esta agregación se parece desencadenar la pinocitosis de los componentes de la membrana por algún mecanismo desconocido. Tales transformaciones membrana puede ser de crucial importancia en la inducción de una respuesta de anticuerpos a un antígeno, así como los procesos iv otras de la diferenciación celular
En la membrana plasmática,los lípidos se disponen formando una bicapa. Las proteínas se intercalan en esa bicapa de lípidos dependiendo de las interacciones con las regiones de la zona lipídica. Existen tres tipos de proteínas según su disposición en la bicapa:
- Proteínas integrales o intrínsecas. Embebidas en la bicapa lipídica, atraviesan la membrana una o varias veces, asomando por una o las dos caras (proteínas transmembrana); o bien mediante enlaces covalentes con un lípido o a un glúcido de la membrana. El aislamiento de ella requiere la ruptura de la bicapa.
- Glucoproteínas. Se encuentran atravesando toda la capa de la membrana celular, su nombre es debido a que contiene glúcidos.
- Proteínas periféricas o extrínsecas. A un lado u otro de la bicapa lipídica, pueden estar unidas débilmente por enlaces no covalentes. Fácilmente separables de la bicapa mediante soluciones salinas, sin provocar su ruptura. Aparecen en la membrana interna y carecen de proteínas transmembranas.
Transporte transmembrana
Existe una comunicación entre ambos lados de la membrana, por medio de los siguientes elementos:- Canales: es la forma habitual de transporte de iones a través de la membrana. Normalmente cada canal transporta de forma específica un ion característico de ése canal. Pueden tener una abertura regulable. Son de vital importancia, por ejemplo, los canales de sodio y potasio para la existencia del potencial de acción transmembrana, el impulso eléctrico que las neuronas emplean para realizar su función a lo largo de todo su axón.
- Transportadores: los transportadores son proteínas que se unen específicamente a la molécula transportada (uniporte). El cambio de forma permite a ésta ser transportada a través de la membrana. Presentan una cinética saturante, cuando no están acoplados a una ATPasa. A veces el transporte de una molécula depende de la coexistencia de un cotransporte para entrar ambos a la vez (simporte) o entrar uno y salir el otro (antiporte).
- Receptores: los receptores también se unen a moléculas específicas, pero en contra del transportador, dicha molécula provoca un cambio conformacional del receptor y activa la emisión de enzimas intracelulares, la molécula señalizadora. También puede activar la emisión de una micela conformada por la propia membrana. La finalidad del receptor es que la señal externa induzca una señal interna de síntesis de una determinada molécula en el interior de la célula.
ARTICULO 2."Las balsas lipídicas: contencioso sólo desde puntos de vista simplistas"
JOHN F.HANCOCK
Una balsa lipídica o raft lipídico es un microdominio de la membrana
plasmática cuya fluidez es mucho menor a la de su entorno. Se encuentran
enriquecidos en colesterol, fosfolípidos saturados y proteínas de membrana. Si
bien su tamaño es variable, típicamente poseen unos 50 nm de diámetro.
Las balsas de lípidos son dominios moleculares situados en la membrana
plasmática, que consisten en asociaciones estables entre los esfingolípidos y el colesterol.
Por ello, estos grupos forman una fase lipídica más densa que los glicerofosfolípidos, y así constituyen zonas especiales de la membrana plasmática que funcionan como "balsas" que flotan entre el conjunto de los demás lípidos.
Se sabe que estas balsas intervienen en gran número de funciones celulares (y cada vez se descubren más), como pueden ser la respuesta a la invasión de patógenos, la homeostasis del colesterol, angiogénesis, transducción de señales, etc.
Estas unidades en la membrana plasmática son muy diversas y dinámicas en cuanto a tamaño y composición, y tienen asociadas proteínas de membrana que les confieren distintas propiedades y funciones. Por lo tanto, teniendo en cuenta estas balsas de lípidos, debemos ver la membrana plasmática como un componente celular heterogéneo en el cual se disponen numerosas balsas de lípidos que cambian en sus propiedades y definen funciones distintas en las regiones de la membrana celular.
Se ha observado que ciertas proteínas relacionadas con los procesos de señalización celular están asociadas con las balsas lipídicas. En este tipo se incluyen las proteínas ancladas a glicosilfosfatidilinositol (GPI), las tirosin-quinasas doblemente aciladas de la familia Src y las proteínas trasmembrana. También puede intervenir en esta asociación, al menos parcialmente, las colas insaturadas y aciladas de las tirosin-quinasas y las proteínas ancladas a GPIs, que concuerdan más con las propiedades de los esfingolípidos que el resto de la membrana. (Simons & Ikonen, 1997). Mientras que estas proteínas tienden a estar continuamente presentes en las balsas lipídicas, hay otras que se asocian con ellas sólo cuando estas proteínas están activadas. Algunos ejemplos de estans incluyen, anque no están limitadas a, receptores de linfocitos B (BCRs), receptores de linfocitos T (TCRs), PAG y una encima llamada CD 39.
Otras proteínas están excluidas de las balsas lipídcas, como el receptor de la transferrina y un miembro de la familia Ras. Típicamente la inclusión o exclusión de las proteínas está determinada por el hecho de que se encuentren en los fragmentos de membrana extraídos utilizando Tritón (según la definición DRM de balsas).
Los investigadores han puesto a prueba la presencia y la importancia de las balsas lipídicas en la señalización celular comprendiendo primero los procesos iniciales de señalización y posteriormente alterando las balsas de lípidos y observando en ese momento cualquier cambio que se produzca en la función celular. Las balsas de lípidos se alteran típicamente eliminando el colesterol de la membrana utilizando para ello sistemas como el de la metil-β-ciclodrexina o antibióticos como la flipina.
En los linfocitos B normales, cuando la célula encuentra un antígeno, los receptores de los linfocitos B se pasan a un dominio de balsa de lípidos y ahí da el relevo de una señal que provoca la proliferación celular en las células plasmáticas y producen anticuerpos. No obstante, cuando se eliminaba el colesterol de los linfocitos B, presumiblemente destruyendo con ello las balsas de lípidos, los receptores de las células B ya no eran capaces de dar el relevo de la señal de que habían encontrado un antígeno y no se producían anticuerpos. De modo similar, cuando las balsas se eliminaban de los linfocitos T, también los TCRs perdían su capacidad de trasmitir las señales cuando encontraban un antígeno.
ARTICULO3. "Reglamento de la membrana plasmática de fosfolípidos transbilayer asimetría"
Los lípidos en las membranas biológicas son asimétricamente distribuidos a través de la bicapa, los fosfolípidos que contienen aminas se enriquecen en la superficie citoplasmática de la membrana plasmática, mientras que los que contengan colina y esfingolípidos se enriquecen en la superficie exterior
Cada célula se encuentra rodeada por una membrana plasmática que la rodea, le da forma, es especifica de la funcion de esta y la relaciona con el medio extracelular.
Actúa como una barrera de permeabilidad que permite a la célula mantener una composición citoplasmática distinta del medio extracelular.
Contiene enzimas, receptores y antígenos que desempeñan un central en la interaccion de la celulas con otras celulas, así como con las hormonas y otros agentes reguladores presentes en él liquido extracelular.
Estructura de la membrana
Los constituyentes más abundantes son las proteínas y fosfolípidos. La molécula fofolípidos presentan una cabeza polar y dos cadenas hidrofóbicas, constituidas por ácidos grasos.
Su presencia fue confirmada con él ME dé transmicion, así la membrana plasmática en transversales apareció como una triple lamina dos elctrodensas y una electrolucida, Robertson designo a esta triple lamina unidad de membrana. Como químicamente evidenciaba el predominio de lípidos y proteínas, se dieron a la búsqueda de un modelo teórico que explicara esta estructura.
Singer y Nicholson propusieron el modelo del mosaico fluido, este es molecular y teórico y se basa en datos de la estructura, la química y la biofísica pero no puede ser visualizado por ME actuales. Propusieron el ensamble de las moléculas de lípidos y proteínas, la hemicapa externa seria totalmente fosfolipídica y la hemicapa interna estaría formada por fosfolípidos y moléculas de intercaladas, esta es asimétrica por que los fosfolípidos de la hemicapa externa difieren de la interna
Proteínas de la membrana
Funcion de bomba
Portadoras
Conductoras
Enzimáticas
Productoras de anticuerpos
* Uniones estables con otras membranas o estructuras intercelulares
* Uniones facultativas, mas o menos estables para fijar elementos que ingresan a la célula.
Entre las proteínas de la membrana se incluyen enzimas, proteínas transportadoras y receptores para hormonas y neurotransmisores.
Glucoproteínas: están situadas exclusivamente en la superficie de la membrana. La carga negativa de la superficie de la célula es atribuible al ácido siálico, con carga negativa de glucolípidos y glucoproteínas.
Composición lipídica
Los lípidos forman una barrera continua, mantienen la individualidad .
Por ello, estos grupos forman una fase lipídica más densa que los glicerofosfolípidos, y así constituyen zonas especiales de la membrana plasmática que funcionan como "balsas" que flotan entre el conjunto de los demás lípidos.
Se sabe que estas balsas intervienen en gran número de funciones celulares (y cada vez se descubren más), como pueden ser la respuesta a la invasión de patógenos, la homeostasis del colesterol, angiogénesis, transducción de señales, etc.
Estas unidades en la membrana plasmática son muy diversas y dinámicas en cuanto a tamaño y composición, y tienen asociadas proteínas de membrana que les confieren distintas propiedades y funciones. Por lo tanto, teniendo en cuenta estas balsas de lípidos, debemos ver la membrana plasmática como un componente celular heterogéneo en el cual se disponen numerosas balsas de lípidos que cambian en sus propiedades y definen funciones distintas en las regiones de la membrana celular.
Se ha observado que ciertas proteínas relacionadas con los procesos de señalización celular están asociadas con las balsas lipídicas. En este tipo se incluyen las proteínas ancladas a glicosilfosfatidilinositol (GPI), las tirosin-quinasas doblemente aciladas de la familia Src y las proteínas trasmembrana. También puede intervenir en esta asociación, al menos parcialmente, las colas insaturadas y aciladas de las tirosin-quinasas y las proteínas ancladas a GPIs, que concuerdan más con las propiedades de los esfingolípidos que el resto de la membrana. (Simons & Ikonen, 1997). Mientras que estas proteínas tienden a estar continuamente presentes en las balsas lipídicas, hay otras que se asocian con ellas sólo cuando estas proteínas están activadas. Algunos ejemplos de estans incluyen, anque no están limitadas a, receptores de linfocitos B (BCRs), receptores de linfocitos T (TCRs), PAG y una encima llamada CD 39.
Otras proteínas están excluidas de las balsas lipídcas, como el receptor de la transferrina y un miembro de la familia Ras. Típicamente la inclusión o exclusión de las proteínas está determinada por el hecho de que se encuentren en los fragmentos de membrana extraídos utilizando Tritón (según la definición DRM de balsas).
Los investigadores han puesto a prueba la presencia y la importancia de las balsas lipídicas en la señalización celular comprendiendo primero los procesos iniciales de señalización y posteriormente alterando las balsas de lípidos y observando en ese momento cualquier cambio que se produzca en la función celular. Las balsas de lípidos se alteran típicamente eliminando el colesterol de la membrana utilizando para ello sistemas como el de la metil-β-ciclodrexina o antibióticos como la flipina.
En los linfocitos B normales, cuando la célula encuentra un antígeno, los receptores de los linfocitos B se pasan a un dominio de balsa de lípidos y ahí da el relevo de una señal que provoca la proliferación celular en las células plasmáticas y producen anticuerpos. No obstante, cuando se eliminaba el colesterol de los linfocitos B, presumiblemente destruyendo con ello las balsas de lípidos, los receptores de las células B ya no eran capaces de dar el relevo de la señal de que habían encontrado un antígeno y no se producían anticuerpos. De modo similar, cuando las balsas se eliminaban de los linfocitos T, también los TCRs perdían su capacidad de trasmitir las señales cuando encontraban un antígeno.
ARTICULO3. "Reglamento de la membrana plasmática de fosfolípidos transbilayer asimetría"
Los lípidos en las membranas biológicas son asimétricamente distribuidos a través de la bicapa, los fosfolípidos que contienen aminas se enriquecen en la superficie citoplasmática de la membrana plasmática, mientras que los que contengan colina y esfingolípidos se enriquecen en la superficie exterior
Cada célula se encuentra rodeada por una membrana plasmática que la rodea, le da forma, es especifica de la funcion de esta y la relaciona con el medio extracelular.
Actúa como una barrera de permeabilidad que permite a la célula mantener una composición citoplasmática distinta del medio extracelular.
Contiene enzimas, receptores y antígenos que desempeñan un central en la interaccion de la celulas con otras celulas, así como con las hormonas y otros agentes reguladores presentes en él liquido extracelular.
Estructura de la membrana
Los constituyentes más abundantes son las proteínas y fosfolípidos. La molécula fofolípidos presentan una cabeza polar y dos cadenas hidrofóbicas, constituidas por ácidos grasos.
Su presencia fue confirmada con él ME dé transmicion, así la membrana plasmática en transversales apareció como una triple lamina dos elctrodensas y una electrolucida, Robertson designo a esta triple lamina unidad de membrana. Como químicamente evidenciaba el predominio de lípidos y proteínas, se dieron a la búsqueda de un modelo teórico que explicara esta estructura.
Singer y Nicholson propusieron el modelo del mosaico fluido, este es molecular y teórico y se basa en datos de la estructura, la química y la biofísica pero no puede ser visualizado por ME actuales. Propusieron el ensamble de las moléculas de lípidos y proteínas, la hemicapa externa seria totalmente fosfolipídica y la hemicapa interna estaría formada por fosfolípidos y moléculas de intercaladas, esta es asimétrica por que los fosfolípidos de la hemicapa externa difieren de la interna
Proteínas de la membrana
- Proteínas integrales intrínsecas = incrustadas total o parcialmente en el espesor de la bicapa. Se mueven lateralmente en la membrana.
Funcion de bomba
Portadoras
Conductoras
Enzimáticas
Productoras de anticuerpos
- Proteínas periféricas o extrínsecas = adosadas por el lado externo y/o interno de la bicapa. Son las más móviles.
* Uniones estables con otras membranas o estructuras intercelulares
* Uniones facultativas, mas o menos estables para fijar elementos que ingresan a la célula.
Entre las proteínas de la membrana se incluyen enzimas, proteínas transportadoras y receptores para hormonas y neurotransmisores.
Glucoproteínas: están situadas exclusivamente en la superficie de la membrana. La carga negativa de la superficie de la célula es atribuible al ácido siálico, con carga negativa de glucolípidos y glucoproteínas.
Composición lipídica
Los lípidos forman una barrera continua, mantienen la individualidad .
- Fosfolípidos principales: los más abundantes suelen ser los que contienen colinas, las lecitinas y las esfingomielinas, aminofosfolipidos, fosfatidilserina y fosfatidiletanolamina. Otros, fosfatadilglicerol, fosfatatidilinositol y la cardiolipina.
- Colesterol: es cuantitativamente importante
- Glucolipidos: se encuentran principalmente en las membranas plasmáticas, en las que sus porciones glucídicas sobresalen de la superficie externa de la membrana. (cerebrosidos y gangliosidos)
- Recepción de la información: las proteínas intrínsecas pueden tener capacidad de captar determinadas sustancias especificas y a partir de ellas transmitir la información celular. Las proteínas intrínsecas con tales cualidades se conocen como receptores.
- Especializaciones
- Mantenimiento de la identidad celular.





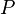 =
=  =
=  =
=  =
=  =
= 










 y
y  son constantes determinadas por la naturaleza del gas con el fin de que haya la
mayor congruencia posible entre la ecuación de los gases reales y el
comportamiento observado experimentalmente.
son constantes determinadas por la naturaleza del gas con el fin de que haya la
mayor congruencia posible entre la ecuación de los gases reales y el
comportamiento observado experimentalmente. 
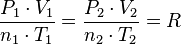


 ,
obtenemos:
,
obtenemos:









