1-¿QUE ES LA MEMBRANA Y DE QUE ESTA CONFORMADA?
R:La membrana plasmática es una estructura laminar formada por fosfolípidos (con cabeza hidrofílica y cola hidrofóbica) y proteínas que engloban a las células, define sus límites y contribuye a mantener el equilibrio entre el interior (medio intracelular) y el exterior (medio extracelular) de éstas.Está formada principalmente por fosfolípidos (fosfatidiletanolamina y fosfatidilcolina), colesterol, glúcidos y proteínas (integrales y periféricas).
2-¿TIPOS DE TRANSPORTE DE MEMBRANA Y EXPLICAR CADA UNO?
R:Difusión simple
Una membrana semipermeable separa dos compartimentos con concentraciones distintas de un soluto: con el paso del tiempo, el soluto difundirá hasta alcanzar el equilibrio a ambos lados.
Como se mencionó anteriormente, la difusión pasiva es un fenómeno espontáneo puesto que suceden incrementando la entropía del sistema, y disminuyendo la energía libre.5 No requiere de la intervención de proteínas de membrana, pero sí de las características de la sustancia a transportar y de la naturaleza de la bicapa. Para el caso de una membrana fosfolipídica pura, la velocidad de difusión de una sustancia depende de su:
- gradiente de concentración,
- hidrofobicidad,
- tamaño,
La difusión facilitada involucra el uso de un proteína para facilitar el movimiento de moléculas a través de la membrana. En algunos casos, las moléculas pasan a través de canales con la proteína. En otros casos, la proteína cambia su forma, permitiendo que las moléculas pasen a través de ella
Transporte activo y cotransporte
En él se efectúa un transporte en contra del gradiente de concentración o electroquímico y, para ello, las proteínas transportadoras implicadas consumen energía metabólica (comúnmente adenosín trifosfato). La hidrólisis del compuesto que actúa como moneda energética puede ser muy evidente, como en el caso de los transportadores que son ATPasas, o puede tener un origen indirecto: por ejemplo, los cotransportadores emplean gradientes de determinados solutos para impulsar el transporte de un determinado compuesto en contra de su gradiente, a costa de la disipación del primer gradiente mencionado. Pudiera parecer que en este caso no interviene un gasto energético, pero no es así puesto que el establecimiento del gradiente de la sustancia transportada colateralmente al compuesto objetivo ha requerido de la hidrólisis de ATP en su generación mediante unos determinados tipos de proteínas denominados bombas.2 Por ello, se define transporte activo primario como aquél que hidroliza ATP de forma directa para transportar el compuesto en cuestión, y transporte activo secundario como aquél que utiliza la energía almacenada en un gradiente electroquímico.
3-¿ QUE ES UN TRANSPORTADOR DE MEMBRANA,TIPOS Y EXPLICAR CADA UNO ?
R:Un transportador puede movilizar diversos iones y moléculas. Según la direccionalidad, se distinguen:
- antiportadores: aquellos que transportan un tipo de molécula en contra de su gradiente al mismo tiempo que desplazan uno o más iones diferentes a favor del suyo, siendo ambos gradientes contrapuestos.
- simportadores: los que desplazan el compuesto a transportar en contra de su gradiente acoplando este trasiego al desplazamiento de uno o más iones diferentes a favor del suyo, que, en este caso, es equivalente al de la molécula a transportar
4¿CUALES SON LOS DOS TIPOS DE TRANSMISIÓN SINAPTICA Y EXPLIQUE EN QUE CONSISTEN?
R:
Sinapsis eléctrica
Una sinapsis eléctrica es aquella en la que la transmisión entre la primera neurona y la segunda no se produce por la secreción de un neurotransmisor, como en las sinapsis químicas (véase más abajo), sino por el paso de iones de una célula a otra a través de uniones gap, pequeños canales formados por el acoplamiento de complejos proteicos, basados en conexinas, en células estrechamente adheridas.Sinapsis química
La sinapsis química se establece entre células que están separadas entre sí por un espacio de unos 20-30 nanómetros(nm), la llamada hendidura sináptica.La liberación de neurotransmisores es iniciada por la llegada de un impulso nervioso (o potencial de acción), y se produce mediante un proceso muy rápido de secreción celular: en el terminal nervioso presináptico, las vesículas que contienen los neurotransmisores permanecen ancladas y preparadas junto a la membrana sináptica. Cuando llega un potencial de acción se produce una entrada de iones calcio a través de los canales de calcio dependientes de voltaje. Los iones de calcio inician una cascada de reacciones que terminan haciendo que las membranas vesiculares se fusionen con la membrana presináptica y liberando su contenido a la hendidura sináptica. Los receptores del lado opuesto de la hendidura se unen a los neurotransmisores y fuerzan la apertura de los canales iónicos cercanos de la membrana postsináptica, haciendo que los iones fluyan hacia o desde el interior, cambiando el potencial de membrana local. El resultado es excitatorio en caso de flujos de despolarización, o inhibitorio en caso de flujos de hiperpolarización. El que una sinapsis sea excitatoria o inhibitoria depende del tipo o tipos de iones que se canalizan en los flujos postsinápticos, que a su vez es función del tipo de receptores y neurotransmisores que intervienen en la sinapsis.
- transmisión excitadora: aquella que incrementa la posibilidad de producir un potencial de acción;
- transmisión inhibidora: aquella que reduce la posibilidad de producir un potencial de acción;
- transmisión moduladora: aquella que cambia el patrón y/o la frecuencia de la actividad producida por las células involucradas.
5¿QUE SON LOS NEUROTRANSMISORES Y CUALES SON?
R:Un neurotransmisor (o neuromediador) es una sustancia química que transmite información de una neurona a otra atravesando el espacio que separa dos neuronas consecutivas (la sinapsis). El neurotransmisor se libera en la extremidad de una neurona durante la propagación del impulso nervioso y actúa en la neurona siguiente fijándose en puntos precisos de la membrana de la otra neurona.
Teniendo en cuenta su composición química se pueden clasificar en:[1]
- Colinérgicos: acetilcolina
- Adrenérgicos: que se dividen a su vez en catecolaminas, ejemplo adrenalina o epinefrina, noradrenalina o norepinefrina y dopamina; e indolaminas serotonina, melatonina e histamina
- Aminoacidérgicos: GABA, taurina, ergotioneina, glicina, beta alanina, glutamato y aspartato
- Peptidérgicos: endorfina, encefalina, vasopresina, oxitocina, orexina, neuropéptido Y, sustancia P, dinorfina A, somatostatina, colecistoquinina, neurotensina, hormona luteinizante, gastrina y enteroglucagón.
- Radicales libres: oxido nítrico (NO), monóxido de carbono (CO), adenosin trifosfato (ATP) y ácido araquidónico.
Principales Neurotransmisores
- Acetilcolina (ACh)
Neuronas motoras en médula espinal → unión neuromuscular
Proscencéfalo basal → numerosas áreas de la corteza
Interneuronas en el cuerpo estriado
Sistema nervioso autónomo → neuronas preganglionares del SNA simpático y parasimpático, y postganglionares del parasimpático.
Localización:
Sustancia negra → vía nigroestriada del cuerpo estriado, sistema límbico y numerosas áreas de la corteza)
Núcleo arcuato del hipotálamo → hipófisis anterior a través de las venas portales
- Noradrenalina (NE)
Lucus Ceruleus de la protuberancia → sistema límbico, hipotálamo, corteza
Bulbo raquídeo → locus coeruleus, médula espinal
Neuronas posganglionares del sistema nervioso simpático
Localización:
Núcleos del rafe protuberancial → múltiples proyecciones
Bulbo raquídeo/Protuberancia → asta posterior de la médula espinal
- Ácido γ-aminobutírico (GABA)
Principal neurotransmisor inhibidor del cerebro; interneuronas corticales muy extendidas y vías de proyecciones largas.
Localización:
Principal neurotransmisor inhibidor de la médula espinal
Localización:
Principal neurotransmisor excitador; localizado por todo el SNC, incluso en células piramidales corticales.
6¿QUE ES UNA PILA Y PRINCIPIO DE FUNCIONAMIENTO?
R:Una pila eléctrica es un dispositivo que convierte energía química en energía eléctrica por un proceso químico transitorio, tras lo cual cesa su actividad y han de renovarse sus elementos constituyentes, puesto que sus características resultan alteradas durante el mismo. Se trata de un generador primario. Esta energía resulta accesible mediante dos terminales que tiene la pila, llamados polos, electrodos o bornes. Uno de ellos es el polo negativo o ánodo y el otro es el polo positivo o cátodo.
PRINCIPIO
Aunque la apariencia de cada una de estas celdas sea simple, la explicación de su funcionamiento dista de serlo y motivó una gran actividad científica en los siglos XIX y XX, así como diversas teorías.
Las pilas básicamente consisten en dos electrodos metálicos sumergidos en un líquido, sólido o pasta que se llama electrolito. El electrolito es un conductor de iones.
Cuando los electrodos reaccionan con el electrolito, en uno de los electrodos (el ánodo) se producen electrones (oxidación), y en el otro (cátodo) se produce un defecto de electrones (reducción). Cuando los electrones sobrantes del ánodo pasan al cátodo a través de un conductor externo a la pila se produce una corriente eléctrica.
7¿QUE ES UNA BATERÍA?
Se denomina batería, batería eléctrica, acumulador eléctrico o simplemente acumulador, al dispositivo que almacena energía eléctrica, usando procedimientos electroquímicos y que posteriormente la devuelve casi en su totalidad; este ciclo puede repetirse por un determinado número de veces. Se trata de un generador eléctrico secundario; es decir, un generador que no puede funcionar sin que se le haya suministrado electricidad previamente mediante lo que se denomina proceso de carga.
8¿QUE ES UN ELECTRODO Y QUE FUNCIÓN TIENE?
Un electrodo es una placa de membrana rugosa de metal, un conductor utilizado para hacer contacto con una parte no metálica de un circuito, por ejemplo un semiconductor, un electrolito, el vacío (en una válvula termoiónica), un gas (en una lámpara de neón), etc.
Tipos de electrodos
- Electrodos para fines médicos, como EEG, EKG, ECT, desfibrilador;
- Electrodos para técnicas de Electrofisiología en investigación biomédica;
- Electrodos para ejecución en silla eléctrica;
- Electrodos para galvanoplastia;
- Electrodos para soldadura;
- Electrodos de protección catódica;
- Electrodos inertes para hidrólisis (hechos de platino);
- Electrodos para puesta a tierra, también conocidos como pica o jabalina;
- Ultramicroelectrodo;
- Electrodo de anillo-disco rotatorio;
- Electrodo de calomelanos;
- Pararrayos.
9¿QUE ES LA ELECTROFORESIS Y TIPOS DE ELECTROFORESIS?
R:La electroforesis es una técnica para la separación de moléculas según la movilidad de estas en un campo eléctrico. La separación puede realizarse sobre la superficie hidratada de un soporte sólido (p. ej., electroforesis en papel o en acetato de celulosa), o bien a través de una matriz porosa (electroforesis en gel), o bien en disolución (electroforesis libre). Dependiendo de la técnica que se use, la separación obedece en distinta medida a la carga eléctrica de las moléculas y a su masa.
TIPOS
1-La electroforesis capilar (EC) es una técnica de separación utilizada en distintas áreas (química, bioquímica, etc.) para separar las diferentes moléculas presentes en una disolución de acuerdo con la relación masa/carga de las mismas. La separación se lleva a cabo en un tubo hueco de diámetro muy pequeño (menos de 50 µm de diámetro), de ahí que reciba el nombre de capilar. Dentro de este capilar se encuentran la disolución que contiene los analitos o las moléculas a separar y el tampón o medio electrolítico que es el encargado de conducir la corriente. Específicamente, el interior se encuentra formado por grupos silanol (Si-OH), los cuales al ser desprotonados (Si-O), elevan considerablemente el potencial de hidrógeno (pH) y favorecen la presencia de analitos específicos. Como se ha dicho, la separación se lleva a cabo según la relación masa/carga de las distintas moléculas. Para que esto sea posible es necesario aplicar una diferencia de potencial (de 100 a 500 V/cm) entre los dos extremos del capilar que hará que las moléculas se muevan hacia un extremo u otro del capilar (movilidad electroforética) (las moléculas catiónicas hacia el polo negativo y las aniónicas hacia el polo positivo) y que se vayan separando entre sí
2-La electroforesis en gel es un grupo de técnicas empleadas por los científicos para separar moléculas basándose en propiedades como el tamaño, la forma o el punto isoeléctrico. La electroforesis en gel se utiliza generalmente con propósitos analíticos, pero puede ser una técnica preparativa para purificar moléculas parcialmente antes de aplicar espectrometría de masas, PCR, clonación o secuenciación de ADN
3-La electroforesis proteica es la separación de proteínas mediante la aplicación de un campo eléctrico.
Existen diferentes tipos en función del tipo de separación empleado: electroforesis de zona (separación en función de la carga), isoelectroenfoque y separación por tamaño en tamiz molecular (también aplicable a ácidos nucleicos).
10¿ FUNCIÓN DE POTENCIOMETRO Y TIPOS?
R: Normalmente, los potenciómetros se utilizan en circuitos de poca corriente. Para circuitos de corrientes mayores, se utilizan los reostatos, que pueden disipar más potencia.
Según su aplicación se distinguen varios tipos:
- Potenciómetros de mando. Son adecuados para su uso como elemento de control en los aparatos electrónicos. El usuario acciona sobre ellos para variar los parámetros normales de funcionamiento. Por ejemplo, el volumen de una radio.
- Potenciómetros de ajuste. Controlan parámetros preajustados, normalmente en fábrica, que el usuario no suele tener que retocar, por lo que no suelen ser accesibles desde el exterior. Existen tanto encapsulados en plástico como sin cápsula, y se suelen distinguir potenciómetros de ajuste vertical, cuyo eje de giro es vertical, y potenciómetros de ajuste horizontal, con el eje de giro paralelo al circuito impreso.
- Potenciómetros lineales. La resistencia es proporcional al ángulo de giro.
- Logarítmicos. La resistencia depende logarítmicamente del ángulo de giro.
- Senoidales. La resistencia es proporcional al seno del ángulo de giro. Dos potenciómetros senoidales solidarios y girados 90° proporcionan el seno y el coseno del ángulo de giro. Pueden tener topes de fin de carrera o no.
- Antilogarítmicos (exponenciales?)...
Potenciómetros multivuelta. Para un ajuste fino de la resistencia existen potenciómetros multivuelta, en los que el cursor va unido a un tornillo desmultiplicador, de modo que para completar el recorrido necesita varias vueltas del órgano de mando.
Tipos de potenciómetros de mando
- Potenciómetros rotatorios. Se controlan girando su eje. Son los más habituales pues son de larga duración y ocupan poco espacio.
- Potenciómetros deslizantes. La pista resistiva es recta, de modo que el recorrido del cursor también lo es. Han estado de moda hace unos años y se usa, sobre todo, en ecualizadores gráficos, pues la posición de sus cursores representa la respuesta del ecualizador. Son más frágiles que los rotatorios y ocupan más espacio. Además suelen ser más sensibles al polvo.
- Potenciómetros múltiples. Son varios potenciómetros con sus ejes coaxiales, de modo que ocupan muy poco espacio. Se utilizaban en instrumentación, autorradios, etc.
Potenciómetros digitales
Se llama potenciómetro digital a un circuito integrado cuyo funcionamiento simula el de un potenciómetro Analógico. Se componen de un divisor resistivo de n+1 resistencias, con sus n puntos intermedios conectados a un multiplexor analógico que selecciona la salida. Se manejan a través de una interfaz serie (SPI, I2C, Microwire, o similar). Suelen tener una tolerancia en torno al 20% y a esto hay que añadirle la resistencia debida a los switches internos, conocida como Rwiper. Los valores mas comunes son de 10K y 100K aunque varia en función del fabricante con 32, 64, 128, 512 y 1024 posiciones en escala logarítmica o lineal. Los principales fabricantes son Maxim, Intersil y Analog Devices. Estos dispositivos poseen las mismas limitaciones que los conversores DAC como son la corriente máxima que pueden drenar, que esta en el orden de los mA, la INL y la DNL, aunque generalmente son monotónicos11¿QUE ES UNA SOLUCIÓN?
Las soluciones en química, son mezclas homogéneas de sustancias en
iguales o distintos estados de agregación. La concentración de una solución
constituye una de sus principales características. Bastantes propiedades de las
soluciones dependen exclusivamente de la concentración. Su estudio resulta de
interés tanto para la física como para la química.
12¿TIPOS DE SOLUCIONES?
PREPARAR SOLUCIONES – CONCENTRACION
*PORCENTUAL
*MOLARES
*NORMALES
*MOLALES
*FORMALES
*FRACCION MOLAR
13¿QUE ES UNA PROPIEDAD COLIGATIVA?
En química se llaman propiedades coligativas a aquellas propiedades de una disolución que dependen únicamente de la concentración (generalmente expresada como concentración molar, es decir, de la cantidad de partículas de soluto por partículas totales, y no de la naturaleza o tipo de soluto).
14¿TIPOS DE PROPIEDADES COLIGATIVAS?
Descenso de la presión de vapor
Cuando se
prepara una solución con un solvente y un soluto no volátil (que
se transformará en gas) y se mide su presión, al compararla con la presión de
vapor de su solvente puro (medidas a la misma temperatura), se observa que la
de la solución es menor que la del solvente. Esto es consecuencia de la
presencia del soluto no volátil.
A su vez,
cuando se las comparan las presiones de vapor de dos soluciones de igual
composición y diferente concentración, aquella solución más concentrada tiene
menor presión de vapor. El descenso de ésta se produce por dos razones: por
probabilidad, pues es menos probable que existan moléculas de disolvente en el
límite de cambio, y por cohesión, pues las moléculas de soluto atraen a las de disolvente
por lo que cuesta más el cambio.
La presión
de vapor de un disolvente desciende cuando se le añade un soluto no volátil.
Este efecto
es el resultado de dos factores:
- La disminución del número de
moléculas del disolvente en la superficie libre.
- La aparición de fuerzas
atractivas entre las moléculas del soluto y las moléculas del disolvente,
dificultando su paso a vapor.
Descenso crioscópico
El soluto
obstaculiza la formación de cristales
sólidos, por ejemplo el líquido anticongelante de los motores
de los automóviles tiene una base de agua pura a presión
atmosférica se congelaría a 0°C dentro de las tuberías y no
resultaría útil en lugares fríos. Para evitarlo se le agregan ciertas sustancias químicas
que hacen descender su punto de congelación.
ΔT = Kf · m
- m es la molalidad. Se
expresa en moles de soluto por kilogramo de disolvente (mol/kg).
- ΔTf es el descenso del punto de
congelación y es igual a Tf - T donde T es el
punto de congelación de la solución y Tf es el punto de
congelación del disolvente puro.
- Kf es una constante de
congelación del disolvente. Su valor, cuando el solvente es agua es
1,86 °C kg/mol.
] Aumento ebulloscópico
Al agregar
moléculas o iones a un solvente puro la temperatura en el que
éste entra en ebullición es más alto.
Por ejemplo, el agua pura a presión atmosférica ebulle a 100 °C, pero si
se disuelve algo en ella el punto de ebullición
sube algunos grados centígrados.
ΔTb = Kb · m
- m es la molalidad. Se
expresa en moles de soluto por kilogramo de disolvente (mol/kg).
- ΔTb es el aumento del punto de
ebullición y es igual a T - Tb donde T es el
punto de ebullición de la solución y Tb el del
disolvente puro.
- Kb es una constante de ebullición
del disolvente. Su valor cuando el solvente es agua es 0,512 °C
kg/mol.
Presión osmótica
La ósmosis es la tendencia que tienen los solventes
a ir desde zonas de menor concentración hacia zonas de mayor concentración de
soluto. El efecto puede pensarse como una tendencia de los solventes a
"diluir". Es el pasaje espontáneo de solvente desde una solución más
diluida (menos concentrada) hacia una solución menos diluida (más concentrada),
cuando se hallan separadas por una membrana semipermeable. La presión osmótica
(π) se define como la presión requerida para evitar el paso de solvente a
través de una membrana semipermeable, y cumple con la expresión:
- n es el número de moles de
partículas en la solución.
- R es la constante
universal de los gases, donde R = 8.314472 J · K-1
· mol-1.
- T es la temperatura en Kelvin.
Teniendo en
cuenta que n/V representa la molaridad (M) de la solución obtenemos:
Al igual que
en la ley de los gases
ideales, la presión osmótica no depende de la carga de las
partículas.
Observación:
Se utiliza la unidad de molaridad (M) para expresar
la concentración ya que el fenómeno de ósmosis ocurre a temperatura constante
(de esto se deduce que las unidades de concentración para el ascenso
ebulloscópico y el descenso crioscópico estén dadas en molalidad (m), ya que
este tipo de expresión no varía con la temperatura).
15¿EN QUE CONSISTE LA TEORIA CINÉTICA?
La teoría cinética de los gases es una teoría física que explica el comportamiento y propiedades macroscópicas de los gases a partir de una descripción estadística de los procesos moleculares microscópicos. La teoría cinética se desarrolló con base en los estudios de físicos como Ludwig Boltzmann y James Clerk Maxwell a finales del siglo XIX.
16¿PRINCIPIOS DE TEORIA CINETICA?
Los
principios fundamentales de la teoría cinética son los siguientes:1
- El número de moléculas es grande y la separación media
entre ellas es grande comparada con sus dimensiones. Por lo tanto ocupan
un volumen despreciable en comparación con el volumen del envase y se
consideran masas puntuales.
- Las moléculas obedecen las leyes de Newton, pero individualmente se
mueven en forma aleatoria, con
diferentes velocidades cada una,
pero con una velocidad promedio que no cambia con el tiempo.
- Las moléculas realizan choques elásticos entre sí, por lo tanto se
conserva tanto el momento lineal
como la energía cinética
de las moléculas.
- Las fuerzas entre moléculas son despreciables,
excepto durante el choque. Se considera que las fuerzas eléctricas o nucleares entre las moléculas son de corto
alcance, por lo tanto solo se consideran las fuerzas impulsivas que surgen
durante el choque.
- El gas
es considerado puro, es decir todas las moléculas son idénticas.
- El gas se encuentra en equilibrio térmico
con las paredes del envase.
Estos
postulados describen el comportamiento de un gas ideal. Los gases reales se aproximan a este comportamiento
ideal en condiciones de baja densidad y temperatura
17¿QUE ES UNA GAS IDEAL?
Un gas ideal es un gas teórico
compuesto de un conjunto de partículas puntuales con desplazamiento aleatorio
que no interactúan entre sí. El concepto de gas ideal es útil porque el mismo
se comporta según la ley de los gases ideales, una ecuación de estado simplificada, y que puede ser
analizada mediante la mecánica estadística
¿18 ¿FORMULA PARA GAS IDEAL DE GAY LUSSAC?
Proceso isobaro (Charles)

19¿FORMULA PARA
GAS IDEAL DE BOYLE?
19¿ecuacion de estado?
La ecuación de estado
La ecuación que describe normalmente la relación entre la presión, el volumen, la temperatura y la cantidad (en moles) de un gas ideal es: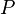 = Presión absoluta(medida en atmósferas)
= Presión absoluta(medida en atmósferas)
 = Volumen (en esta ecuación el volumen
se expresa en litros)
= Volumen (en esta ecuación el volumen
se expresa en litros)
 = Moles de Gas
= Moles de Gas
 = Constante universal de los
gases ideales
= Constante universal de los
gases ideales
 = Temperatura
absoluta
= Temperatura
absoluta
20¿cual es la Teoría cinética molecular?
Esta teoría fue desarrollada por Ludwig Boltzmann y Maxwell. Nos indica las propiedades de un gas ideal a nivel molecular.- Todo gas ideal está formado por N pequeñas partículas puntuales (átomos o moléculas).
- Las moléculas gaseosas se mueven a altas velocidades, en forma recta y desordenada.
- Un gas ideal ejerce una presión continua sobre las paredes del recipiente que lo contiene, debido a los choques de las partículas con las paredes de este.
- Los choques moleculares son perfectamente elásticos. No hay pérdida de energía cinética.
- No se tienen en cuenta las interacciones de atracción y repulsión molecular.
- La energía cinética media de la translación de una molécula es directamente proporcional a la temperatura absoluta del gas.
21¿La ecuación de estado para gases reales?
| Valores de R |
|---|
 |
 |
 |
 |
 |
 |
 |
 |
 |
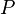 = Presión del gas
= Presión del gas
 = Volumen del gas
= Volumen del gas
 = Número de moles de gas
= Número de moles de gas
 = Constante universal de los
gases ideales
= Constante universal de los
gases ideales
 = Temperatura del gas
= Temperatura del gas
 y
y  son constantes determinadas por la naturaleza del gas con el fin de que haya la
mayor congruencia posible entre la ecuación de los gases reales y el
comportamiento observado experimentalmente.
son constantes determinadas por la naturaleza del gas con el fin de que haya la
mayor congruencia posible entre la ecuación de los gases reales y el
comportamiento observado experimentalmente.
22¿Ecuación general de los gases ideales?
partiendo de la ecuación de estado:
23¿Formas alternativas?
Como la cantidad de sustancia podría ser dada en masa en lugar de moles, a veces es útil una forma alternativa de la ley del gas ideal. El número de moles (n) es igual a la masa (m) dividido por la masa molar (M): ,
obtenemos:
,
obtenemos:En mecánica estadística las ecuaciones moleculares siguientes se derivan de los principios básicos:
Desde aquí podemos observar que para que una masa de la partícula promedio de μ veces la constante de masa atómica m U (es decir, la masa es μ U)
24¿ Desde la mecánica estadística?
Que q = (qx, qy, qz) and p = (px, py, pz) indique el vector de posición y el vector del movimiento de una partícula de un gas ideal, respectivamente. Que F indique la fuerza neta sobre la partícula. Entonces, el tiempo medio de impulso de la partícula es::
donde la primera igualdad es la segunda ley de Newton, y la de segunda línea usa la ecuación de Hamilton y el teorema de equipartición. Sumando sobre un sistema de N, los rendimientos de las partículas
- 25¿ Leyes de Charles y Gay-Lussac?
Proceso isobaro (Charles)
Proceso isocoro ( Gay Lussac)
26¿ Ley de Avogadro?
La Ley de Avogadro fue expuesta por Amedeo Avogadro en 1811 y complementaba a las de Boyle, Charles y Gay-Lussac. Asegura que en un proceso a presión y temperatura constante (isobaro e isotermo), el volumen de cualquier gas es proporcional al número de moles presente, de tal modo que:27¿QUE ES PRESION DE VAPOR?
La presión de vapor es la presión de la fase gaseosa o vapor de un sólido o un líquido sobre la fase líquida, para una temperatura determinada, en la que la fase líquida y el vapor se encuentra en equilibrio dinámico; su valor es independiente de las cantidades de líquido y vapor presentes mientras existan ambas. Este fenómeno también lo presentan los sólidos; cuando un sólido pasa al estado gaseoso sin pasar por el estado líquido (proceso denominado sublimación o el proceso inverso llamado deposicitación o sublimación inversa) también hablamos de presión de vapor
28¿ QUE ES PRESION OSMOTICA?
La presión osmótica puede definirse como la presión que se debe aplicar a una solución para detener el flujo neto de disolvente a través de una membrana semipermeable.[1] La presión osmótica es una de las cuatro propiedades coligativas de las soluciones (dependen del número de partículas en disolución, sin importar su naturaleza). Se trata de una de las características principales a tener en cuenta en las relaciones de los líquidos que constituyen el medio interno de los seres vivos, ya que la membrana plasmática regula la entrada y salida de soluto al medio extracelular que la rodea, ejerciendo de barrera de control.
29¿ EN QUE CONSISTE LA OSMOSIS?
La ósmosis es un fenómeno físico relacionado con el comportamiento de un sólido como soluto de una solución ante una membrana semipermeable para el solvente pero no para los solutos. Tal comportamiento entraña una difusión simple a través de la membrana, sin "gasto de energía". La ósmosis del agua es un fenómeno biológico importante para la fisiología celular de los seres vivos.
30¿QUE SON LOS OSMORREGULADORES?
La osmorregulación es la forma activa de regular la presión osmótica del medio interno del cuerpo para mantener la homeostasis de los líquidos del cuerpo; esto evita que el medio interno llegue a estados demasiado diluidos o concentrados. La presión osmótica es la medida de la tendencia del agua para moverse de una solución a otra por medio de la ósmosis
















No hay comentarios:
Publicar un comentario