Normalidad
Al igual que la molaridad, esta unidad de
concentración se basa en el volumen de solución. La normalidad se define como
el número de equivalentes del soluto por litro de solución
en donde
N es la normalidad, #eg es el número de equivalentes, y V es el volumen de la
solución expresado en litros. Esta definición puede ser extendida cuando se
emplea el concepto de miliequivalente gramo y el volumen se maneja en
mililitros ya que (usando el análisis dimensional):
A continuación se define e ilustra la
determinación de la masa del equivalente-gramo en los diferentes tipos de
reacciones. Esto se basa en que en las reacciones químicas las sustancias
reaccionan equivalente a equivalente. Este es el fundamento de la volmetría,
cuestión que veremos con más detalle en otra sección.
1. Reaccioness de neutralización. La
masa del equivalente-gramo de una sustancia en volumetrías de neutralización es
la masa de la sustancia que puede suministrar, reaccionar con, o ser
químicamente equivalente a un átomo gramo de protones (H+) en la
reacción que tiene lugar. Así, la masa del equivalente-gramo del HCl
coincide con su masa molecular; la masa del equivalente-gramo del H2S04
es la mitad de la masa molecular. La masa del equivalente-gramo del
ácido acético, CH3COOH coincide con su masa molecular; el hecho de
que el ácido acético esté débilmente ionizado nada tiene que ver con la
equivalencia, pues en su reacción con una base el ácido acético aporta a la
reacción todo su contenido en protones. Las tres etapas de la ionización del
ácido fosfórico, H3P04, condiciona que puede proporcionar
protones (o ser neutralizado) por etapas, en reacciones independientes con puntos
finales propios. Por consiguiente, el ácido fosfórico tiene masas del
equivalente-gramo diferentes, representados por H3P04/1,
H3P04/2 y H3P04/3, según se
neutralicen 1, 2 o sus 3 protones. Es un principio universal que la masa del
equivalente-gramo está determinado por la reacción que tenga lugar.
La masa del equivalente-gramo de una base es la masa
de ella que reacciona con o acepta un átomo gramo de protones. Así, la masa del
equivalente-gramo del hidróxido sódico es NaOH/1; el del hidróxido bárico,
Ba(OH)2/2; el del carbonato sódico, Na2CO3/1
cuando pasa a HCO3~, y Na2CO3/2 cuando pasa a
H2C03.
2. Formación de precipitados, complejos o
electrolitos débiles. En este tipo de volumetrías, la masa del
equivalente-gramo de una sustancia es la masa de la misma que proporciona,
reacciona con, o es quimicamente equivalente a un átomo gramo de un
catión monovalente en el precipitado, complejo o electrolito formado. En
la precipitación volumétrica del cloruro de plata, un mol de AgNO3 contiene
un equivalente, porque es la cantidad de dicha sustancia que aporta un átomo
gramo de Ag+, catión monovalente, en el precipitado. En la misma
reacción la masa del equivalente-gramo del KCl coincide con su masa molecular,
pues dicho compuesto aporta la cantidad de ion cloruro que reacciona con un
átomo gramo del catión monovalente Ag+. En su precipitación en forma
de AgCl, la masa del equivalente-gramo del cloruro de bario es BaCl2/2.
Si se precipita en forma de BaCrO4 la masa del equivalente-gramo del
K2CrO4 es K2CrO4/2, porque la mitad
dla masa molecular aporta una cantidad de ion cromato que reacciona con la
mitad de un átomo gramo del catión divalente Ba2+ para formar
el precipitado de BaCrO4. La mitad del átomo gramo de un catión
divalente es equivalente a un átomo gramo de un catión monovalente.
En la reacción
la masa del equivalente-gramo del cianuro potásico
es 2KCN, pues se necesitan 2CN- para completar la reacción con un
átomo gramo del catión monovalente Ag+ en la formación del complejo.
Obsérvese que la equivalencia del KCN se funda en su reacción con Ag+,
y no en el ion potasio del KCN; el K+ no juega ningún papel en la
reacción. La equivalencia fundada en la monovalencia del potasio conduciría a
una conclusión errónea. En la formación del electrolito débil HgCl2,
el equivalente del NaCl coincide con la masa molecular; pero en la formación
del complejo HgCl4-, el equivalente es 2NaCl. No puede
darse un énfasis mayor a la afirmación de que el equivalente se determina
mediante la reacción que tiene lugar.
3. Reacciones redox. En volumetrías redox, la
masa del equivalente-gramo de una sustancia es la masa de la misma que
aporta, recibe (reacciona con) o es químicamente equivalente a un
mol de electrones transferidos en la reacción que tenga lugar.
La mejor forma de deducir el equivalente de una
sustancia es escribir la ecuación de su semirreacción ion-electrón y observar
el número de electrones necesarios por cada mol de la sustancia que interesa.
De la misma forma que los ácidos polipróticos pueden tener masas de
equivalente-gramo diferentes, las sustancias que pueden sufrir varios cambios
diferentes de electrones, tienen en cada cambio distinto peso equivalente. Por
ejemplo, la masa del equivalente-gramo del permanganato potásico es su masa
molecular dividida por 5, o 3, según se reduzca a Mn2+ o MnO2 respectivamente.
En la semirreacción
el equivalente del
dicromato de potasio es su peso fórmula entre 6.
Ejemplos de cálculos relacionados con la
molaridad.
Ejercicio 1.
Calcule la normalidad de una disolución de ácido
sulfúrico que se prepara disolviendo 2 mL de ácido concentrado al 95 %
(densidad 1.84 g/L) en agua y aforando hasta 250 mL.
R/
Ejercicio 2.
Calcule el número de gramos de Na2CO3
puro que se requieren para preparar 250 ml de una solución 0.150 N. El
carbonato de sodio se va a titular con HCl de acuerdo a la ecuación:
R/ Cada mol de Na2CO3reacciona
con dos moles de H+, por lo que su peso equivalente es la mitad de
su peso molecular, o sea 105.99/2 = 53.00 g/eq. De aquí:
Ejercicio 3.
Calcule la normalidad de una solución de nitrato de
níquel preparada al disolver 2.00 g de níquel metálico puro en ácido nítrico y
diluyendo a 500 ml. Al titular el níquel con KCN ocurre la siguiente reacción:
R/ El peso equivalente del níquel es la mitad de su
peso atómico debido a que el níquel es un ion divalente. Por lo tanto,
Título o titro de las disoluciones.
Lo referente a la reacción equivalente a equivalente
de las sustancias en las reacciones químicas nos conduce a que hay otra manera
de expresar la concentración y que es de mucho empleo en química analítica, que
es el título de una solución. Las unidades del título están dadas en peso por
unidad de volumen, pero el peso en lugar de ser el del soluto es el de la
sustancia con la que reacciona la solución. Por ejemplo, si 1.00 ml de solución
de hidróxido de sodio neutraliza exactamente a 2 mg de ácido acético, la
concentración del hidróxido se puede expresar como igual a 2.00 mg de ácido
acético por mL. La concentración como título (T) se puede convertir fácilmente
a normalidad y viceversa, como se ve en la siguientes relación:
Tomando en cuenta que la masa del equivalente que se
toma es la de la sustancia con que reacciona la solución y no la del soluto.
Ejercicio 4.
Determine el título en cloruro del nitrato de plata
0.01N.
Molalidad
La molalidad
(m) es el número de moles de soluto que contiene un kilogramo de disolvente.
Para preparar disoluciones de una determinada molalidad, no se emplea un matraz
aforado como en el caso de la molaridad, sino que se puede hacer en un vaso de precipitados y pesando con una balanza analítica,
previo peso del vaso vacío para poderle restar el correspondiente valor.
La principal
ventaja de este método de medida respecto a la molaridad es
que como el volumen de una disolución depende de la temperatura
y de la presión,
cuando éstas cambian, el volumen cambia con ellas. Gracias a que la molalidad
no está en función del volumen, es independiente de la temperatura y la
presión, y puede medirse con mayor precisión.
Es menos
empleada que la molaridad pero igual de importante
EJEMPLO
Calcular la concentración molal de
una solución que contiene 18 g de NaOH en 100 mL de agua. Puesto que la
densidad del agua es 1 g/mL, 100 mL de agua = 100 g de agua:
Formalidad
El número de
peso-fórmula-gramo tiene unidad de g / PFG
Calcular la
formalidad de una solución de hidróxido de potasio al 26.8 %p/p que contiene
una densidad de 1.255g/Ml
Formalidad=
nùmero de pesos fòrmula de soluto/ 1l de soluciòn.
`Densidad= masa/ volumen ; volumen= masa/ densidad
vol. de soluciòn = 100g/1,255g/ml = 79,7ml.de soluciòn
79,7ml soluciòn----contienen--->26,8g soluto
1000ml soluciòn---------------------x= 336.3 g soluto
KOH, peso molecular = 56
56g---------------1 peso fòrmula
336,3g--------------x = 6 pesos fòrmula
Rta: la soluciòn es 6 Formal
`Densidad= masa/ volumen ; volumen= masa/ densidad
vol. de soluciòn = 100g/1,255g/ml = 79,7ml.de soluciòn
79,7ml soluciòn----contienen--->26,8g soluto
1000ml soluciòn---------------------x= 336.3 g soluto
KOH, peso molecular = 56
56g---------------1 peso fòrmula
336,3g--------------x = 6 pesos fòrmula
Rta: la soluciòn es 6 Formal
Fracción molar
La fracción
molar es una unidad química usada para expresar la concentración
de soluto en una
solución.
Nos expresa la proporción en que se encuentran los moles de soluto con
respecto a los moles totales de solución, que se calculan sumando los moles de
soluto(s) y de solvente. Para calcular la fracción molar de una mezcla
homogénea, se emplea la siguiente expresión:
Donde nsol
serían los moles de soluto y ndisol los moles de la solución
completa y, todo esto, multiplicado por 100.
Como el volumen de una disolución depende de la temperatura
y de la presión;
cuando éstas cambian, el volumen cambia con ellas. Gracias a que la fracción
molar no está en función del volumen, es independiente de la temperatura y la
presión.
Además cabe
notar que en los gases ideales la variación del volumen será proporcional para cada uno de los
solutos, y por lo tanto también para la solución. De esta manera hay una
relación directa entre las fracciones molares y los volúmenes parciales.
Por ejemplo, en una mezcla binaria de 6 moles de etanol y 4 moles de agua, lo que da un total de 10 moles, la fracción molar del etanol es de 6/10 = 0,6; mientras que la fracción molar del agua es 4/10 = 0,4. Todas las fracciones molares de una disolución serán siempre menores que 1, y la suma de éstas dará como resultado 1.
Enlaces
http://es.wikipedia.org/wiki/Fracci%C3%B3n_molar












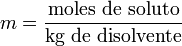




No hay comentarios:
Publicar un comentario